Importante ricerca pubblicata sostenuta da Amicodivalerio ONLUS
Nonostante i recenti progressi nella cura dei tumori infantili, i tumori cerebrali rappresentano ancora un’importante sfida in campo oncologico.
Il gruppo di Neuro-oncologia dell’Ospedale Pediatrico Meyer di Firenze sta realizzando degli studi di ricerca mirati a capire quali siano le alterazioni molecolari caratteristiche dei tumori più aggressivi come i gliomi maligni (glioblastoma multiforme), il medulloblastoma ricaduto e l’ependimoma anaplastico; inoltre lo stesso gruppo sta lavorando su modelli pre-clinici sulle alterazioni farmaco-indotte della barriera emato-encefalica (BEE).
La ricerca sui tumori cerebrali pediatrici della Neuro-oncologia del Meyer ha come obiettivi:
- studiare i meccanismi biologici di farmacoresistenza dei tumori cerebrali poor responderà dell’età pediatrica attraverso un modello terapeutico murino di apertura della BEE, trasferibile in ambito umano;
- valutare gli effetti citotossici di farmaci chemioterapici su linee cellulari tumorali cerebrali e confrontare l’espressione genica di varie proteine cellulari e di un set di microRNA, piccole molecole di RNA che regolano l’espressione genica a livello post-trascrizionale, e coinvolte nella patogenesi dei più frequenti tumori cerebrali pediatrici in assenza e presenza del trattamento farmacologico;
- indagare i meccanismi molecolari alla base dell’azione dei chemioterapici oggi maggiormente utilizzati;
- investigare la genetica molecolare delle neoplasie cerebrali attraverso linee cellulari immortalizzate e colture cellulari primarie per individuare bersagli terapeutici e caratterizzare i profili di espressione dei tumori “poor responder”.
La modulazione della barriera emato-encefalica (BEE) in modelli animali
La barriera emato-encefalica (BEE) costituisce un importante ostacolo fisico e fisiologico alla diffusione di agenti antineoplastici nel cervello. Ne consegue che le procedure di apertura temporanea della stessa potrebbero incrementare la concentrazione di farmaco in sede tumorale. A riguardo, risulta particolarmente promettente l’uso di morfina a basse dosi non neurotossiche da associare all’uso della chemioterapia con farmaci quali antracicline e taxoli (farmaci particolarmente attivi in ambito neuro-oncologico, ma incapaci di attraversare la BEE) in aggiunta al trattamento radioterapico.
Recentemente, grazie al lavoro condiviso tra il gruppo di Neuro-oncologia dell’Ospedale Pediatrico Meyer e a ricercatori afferenti al Dipartimento di farmacologia dell’Università degli Studi di Firenze, è stato dimostrato che la morfina provoca una modulazione reversibile della BEE aumentandone la permeabilità ad agenti chemioterapici come la doxorubicina, una antraciclina ad ampio spettro antitumorale, ponendo le basi per il suo utilizzo insieme con altri farmaci antineoplastici per il trattamento dei tumori cerebrali “poor-responder”.
L’obiettivo di ricerca sarà quello di espandere questa osservazione preliminare, per comprendere il meccanismo dell’azione di “permeabilizzazione” della BEE indotto dalla morfina, capire se questo possa essere un fenomeno comune, condiviso da altri farmaci e sfruttare tale metodo per il trattamento di tumori cerebrali in un modello animale.
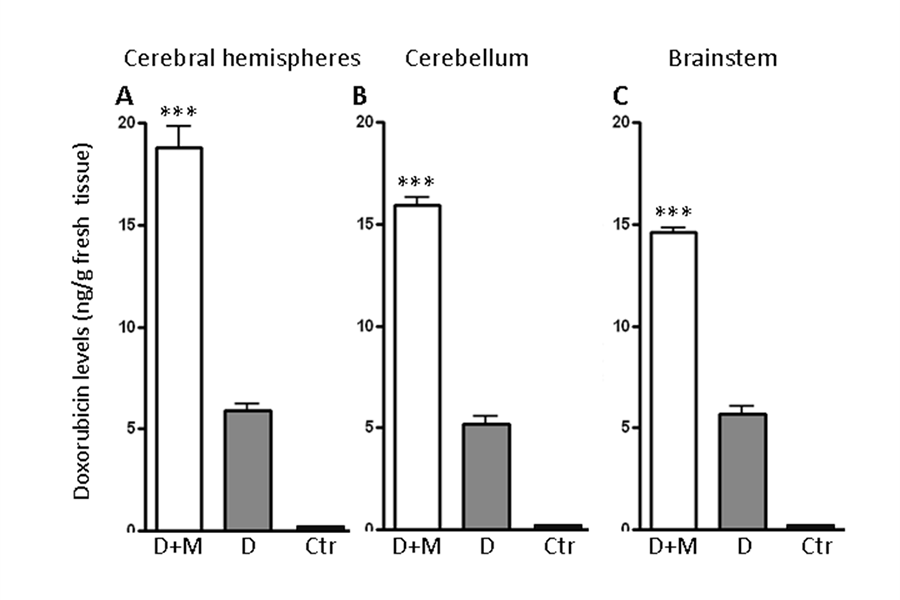
Livelli di doxorubicina dopo pre-trattamento con morfina in cervello di ratto (Sardi et al, Cancer Chemother Pharmacol, 2010)
Il lavoro sperimentale: gli esperimenti in vitro e l’analisi genetica-molecolare
Parallelamente agli esperimenti di modulazione della barriera emato-encefalica in modelli animali, il gruppo di Neurooncologia si è posto l’obiettivo di valutare gli effetti citotossici di farmaci chemioterapici su linee cellulari tumorali cerebrali, confrontando l’espressione genica di varie proteine cellulari e di un set di microRNA coinvolti nella patogenesi dei più frequenti tumori cerebrali pediatrici, in assenza e presenza del trattamento farmacologico. Il primo esperimento ù stato compiuto sulla linea cellulare di glioblastoma-astrocitoma U87MG (human glioblastoma-astrocytoma, epithelial like cell line- Malignant glioma) sulla quale abbiamo valutato gli effetti del trattamento farmacologico con etoposide in termini di espressione dell’enzima topoisomerasi II e di un set di microRNA (miR-21, miR-128, miR-137, miR-7 e miR-124), che sono coinvolti nella patogenesi dei gliomi ad alto grado e dei glioblastomi.
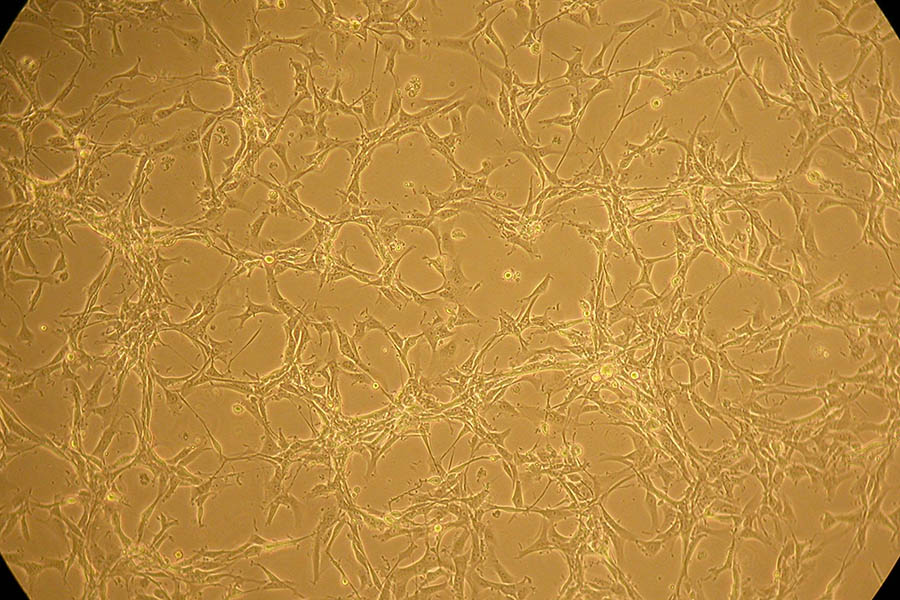
Linea cellulare U87MG: morfolgia epiteliale, crescita monostrato, tumore glioblastoma-astrocitoma, specie umana.
L’etoposide (VP-16) è un inibitore della topoisomerasi II, enzima implicato nella replicazione e divisione cellulare, e viene oggi utilizzato nella terapia di molte neoplasie maligne, soprattutto dei tumori cerebrali per la sua elevata permeabilità alla BEE. Sperimentalmente abbiamo definito un appropriato protocollo di crescita della linea cellulare U87MG, dopodiché abbiamo proceduto alla determinazione della concentrazione di etoposide in grado di indurre l’arresto della divisione cellulare (concentrazione citostatica) attraverso il trattamento della linea con diverse concentrazioni di etoposide e successivi studi di vitalità cellulare.
I dati ottenuti dai nostri esperimenti hanno mostrato che le cellule U87MG trattate con l’etoposide a tempi diversi esibiscono un profilo di espressione per la topoisomerasi II opposto (down-regolato) a quello di cellule U87MG di controllo (up-regolato), risultato che conferma l’azione dell’etoposide nell’inibizione della topoisomerasi II e nell’arresto della divisione cellulare. Riguardo allo studio di espressione del set dei 5 microRNA sopra descritti, abbiamo osservato una modulazione di miR-21, miR-128 e miR-137. In particolare, il livello di espressione di miR-21 versus il rispettivo controllo non trattato è risultato essere quasi nullo.
Troviamo tuttora in corso l’analisi molecolare del meccanismo d’azione dell’etoposide su altre due linee cellulari di tumori cerebrali (Daoy e T98G).
Seguendo lo stesso protocollo sperimentale utilizzato per la linea cellulare U87MG, stiamo valutando l’espressione del set di 5 microRNA (miR-21, miR-128, miR-137, miR-7 e miR-124), della topoisomerasi II e del gene MDR1 (la cui espressione verrà studiata anche sulla linea U87MG), in assenza e presenza del trattamento farmacologico.
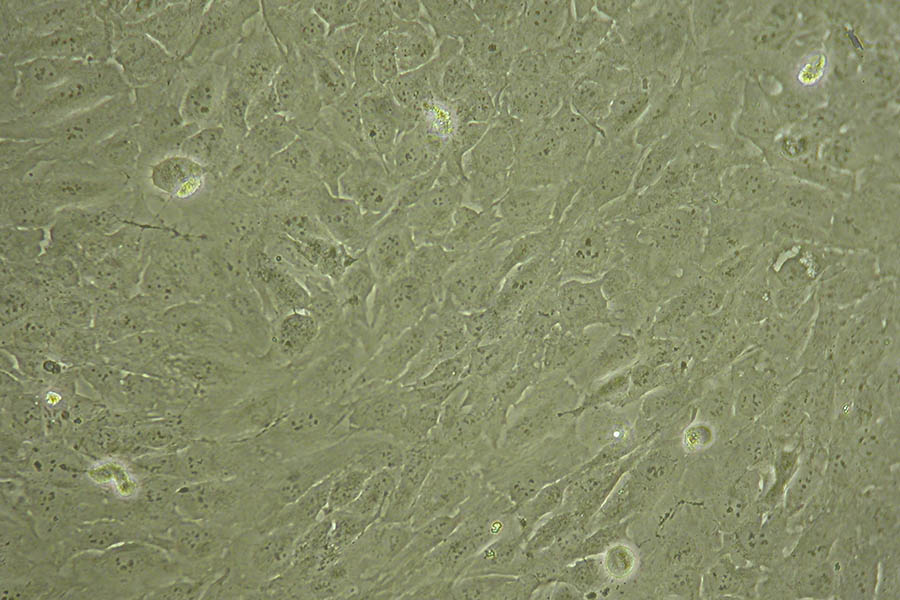
Linea cellulare Daoy: morfolgia poligonale, crescita adesione, tumore medulloblastoma desmoplastico, specie umana
Il lavoro sulle linee cellulari rappresenta infatti un modello in vitro per lo studio del processo di tumorigenesi e di resistenza ai farmaci in vivo, in cui il gene MDR1 (Multidrug Resistance 1) è fortemente coinvolto, codificando i 1280 aminoacidi della glicoproteina-P, uno dei più importanti trasportatori ABC che regolano la distribuzione dei farmaci nel corpo umano.
La glicoproteina-P è stata identificata inizialmente in cellule tumorali, la cui resistenza agli agenti antitumorali era dovuta ad una sua iper-espressione. Questo trasportatore ABC manifesta la sua funzione limitando l’assorbimento e la distribuzione del farmaco nei tessuti e provvedendone all’eliminazione attiva. Ciò determina l’insuccesso della terapia farmacologica poiché un’adeguata concentrazione locale intracellulare del farmaco è un requisito fondamentale per ottenere un’efficacia terapeutica.
Su queste stesse linee cellulari saranno inoltre testati altri chemioterapici come doxorubicina, carboplatino, cisplatino, studiando il profilo di espressione genica dei rispettivi target pre- e post-trattamento, al fine di comprendere il meccanismo dell’azione molecolare dei più potenti agenti antineoplastici oggi in uso e costruire un modello sperimentale da poter, poi, applicare allo studio in vivo dei tumori cerebrali pediatrici.
L’identificazione di specifiche alterazioni genetiche così come l’analisi del profilo di espressione genica potrà quindi aiutare a definire sottogruppi di malattia, attribuire a ciascun fenotipo tumorale la propria firma genetica e molecolare, fornire informazioni prognostiche, rivelare importanti aspetti della biologia del tumore, il tutto a beneficio della qualità di vita del bambino.
DOCUMENTO ORIGINALE




